Hongos micorrizógenos arbusculares y su efecto en el desarrollo de plantas de ají (Capsicum annuum, Solanaceae)
Arbuscular mycorrhizal fungi and its effect on the pepper plants development (Capsicum annuum, Solanaceae)
Jorge A. Luna[1]*, Isaac M. Romero[2], Keidys J. Rojas[3].
RESUMEN
Los hongos micorrizógenos contribuyen al crecimiento y desarrollo de diferentes especies vegetales, aumentando la productividad de los cultivos. El propósito de esta investigación fue evaluar la interacción entre hongos micorrizogénos obtenidos en la granja experimental de la Universidad del Magdalena y su efecto en el desarrollo de plantas de ají. La masificación de las micorrizas arbusculares se hizo siguiendo el método de plantas trampas. Se planteó un diseño experimental aleatorio conformado por seis tratamientos y tres testigos;; a partir de mezclas de suelo con turba, adicionándole 10 g de suelo inoculado con hongos seleccionados (morfotipos hongo 1 y hongo 2). Las variables evaluadas correspondieron a los parámetros de desarrollo de las plantas de ají (número de hojas, altura, largo radicular y peso seco) y tipo de hongo, durante cuatro meses. Se identificaron tres géneros: Glomus, Acaulospora y Gigaspora;; siendo los dos primeros los más abundantes y seleccionados para ensayos de micorrización. Las mezclas suelo-turba en proporción 70:30 adicionadas de Glomus registraron mejor crecimiento y desarrollo comparadas con el resto de tratamientos. Las variables evaluadas en plantas de ají inoculadas con Glomus y Acaulospora mostraron mayor rendimiento significativo comparados con los testigos, número de hojas (8,0 - 8,5), altura de las plantas (8,5 – 13,2 cm), longitud radicular (6,0 – 7,2 cm) y peso seco (0,26 – 0,28 g). Se encontró que el adicionamiento de hongos micorrizogénos representa una estrategia factible en producción de cultivos.
PALABRAS CLAVES: crecimiento y desarrollo., micorrizas., rizósfera., simbiosis.
ABSTRACT
Micorrhizals fungi contribute to growth and development of different plant species, increasing crop productivity. The aim of this research was to evaluate the interaction between micorrhizals fungi obtained in the experimental farm from the University of Magdalena. Massification of the arbuscular mycorrhizal was done according the method of plant trap. An experimental random design of six treatments and three witnesses was proposed;; from mixtures of soil with peat, adding 10 g of soil inoculated with selected fungi (morphotypes fungi 1 and fungi 2). The evaluated variables corresponded to development parameters of pepper plants (number of leaves, height, length radicular and dry weight) and type of fungi, for four months. Three genders were identified: Glomus, Acaulospora and Gigaspora;; being the two first most abundant and selected for tests of micorrhization. The mixtures soil-peat in proportion 70:30 added of Glomus registered better growth and development compared with the rest of treatments. The variables evaluated in pepper plants inoculated with Glomus and Acaulospora showed major significant yield compared with the witness, number of leaves (8,0 - 8,5), plant height (8,5 - 13,2 cm), length radicular (6,0 - 7,2 cm) and dry weight (0,26 - 0,28 g). It was found that adding of fungi micorrhizals represents a feasible strategy in crop production.
KEY WORDS: growth and development, mycorrhizae, rhizosphere, symbiosis.
[1] * M.Sc. Microbiología. Docente Tiempo Completo, Programa de Biología, Universidad del Magdalena, Santa Marta, Magdalena. Colombia. Carrera 32 # 22 – 08 San Pedro Alejandrino. PBX (57) (5) 4217940 Ext. 3242 – 1319. Mail: jorgealbertolunafontalvo@gmail.com
[2] Biólogo. Coordinador Laboratorio de Calidad de Agua, Universidad del Magdalena, Santa Marta, Magdalena. Colombia. Carrera 32 # 22 – 08 San Pedro Alejandrino. PBX (57) (5) 4217940 Ext. 3272
[3] Bióloga. Programa de Biología, Universidad del Magdalena, Santa Marta, Magdalena. Colombia. Carrera 32 # 22 – 08 San Pedro Alejandrino. PBX (57) (5) 4217940 Ext. 3242
INTRODUCCIÓN
Los hongos de la división Glomeromycota se caracterizan por establecer relaciones de tipo mutualista (simbiosis) con un amplio grupo de plantas vasculares, estrictamente a la relación entre los hongos con las raíces de las plantas se les conoce como Micorrizas (Aguilera et al. 2007;; Błaszkowski et al. 2015). Los hongos micorrizógenos desarrollan múltiples funciones benéficas para las plantas en las que se destacan: aprovechamiento eficiente de agua y nutrientes, mayor resistencia a las toxinas, incremento en la solubilización, absorción y transporte de elementos nutritivos esenciales, aumento en la tolerancia a condiciones abióticas adversas (sequía, salinidad, etc.), así como cierta protección contra patógenos radicales (Rivera et al. 2003;; Munkvold et al. 2004;; Sharif y Claassen 2011).
Las asociaciones de micorrizas generalmente se consideran no específicas, es decir, que cualquier hongo simbionte puede colonizar cualquier planta receptiva. Sin embargo, existen algunas preferencias o mejor afinidad entre determinadas parejas hongo-planta, sobre todo en las asociaciones de tipo endomicorrizas (Micorrizas Arbusculares) donde la asociación se da con más especificidad y mayor fuerza que en ectomicorrizas (Micorrizas de manto). Así mismo, existen plantas que no son colonizadas por hongos micorrizógenos (Cyperaceae y Juncaceae);; no obstante, suelen encontrarse especies de plantas de zonas húmedas que no presentan micorrización en época húmeda, pero pueden ser colonizadas en época seca (Azcón-Aguilar et al. 2003;; Jeffries et al. 2003;; Pérez y Peroza 2013).
Se reconoce que la composición y dinámica de las comunidades de hongos micorrizógenos arbusculares (Glomeromycota) tienen un marcado impacto sobre la estructura, diversidad y productividad de las comunidades vegetales con las que se asocian tanto en ecosistemas naturales como agrícolas. La disminución o pérdida de la actividad micorrízica y la diversidad morfológica y funcional de los hongos pueden tener efectos adversos sobre el establecimiento y funcionamiento de la comunidad vegetal (Van Der Heijden et al. 1998;; Boonlue et al. 2012;; Sharma et al. 2014).
La familia Solanaceae está comprendida ampliamente por una diversidad de especies de interés agronómico y comercial, como lo es el género Capsicum que incluye a las plantas de pimentón, chile y ají. Varios estudios demuestran que éstas especies vegetales responden positivamente a las relaciones mutualistas con hongos formadores de micorrizas arbusculares (compatibilidad) como los son Glomus y Acaulosporas, los cuales causan un efecto de inoculación rápido en la planta generando de esta manera una mayor producción, vigorosidad, altura, peso y área foliar (Castillo et al. 2009;; Baum et al. 2015). A pesar de que se conoce que los hongos micorrizógenos hacen parte de la microbiota del suelo y tienen relevancia en la productividad vegetal de interés agrícola, en la Granja Experimental de la Universidad del Magdalena (GEUM) es poca la atención que se les ha tenido, desconociendo la diversidad y abundancia de estos hongos y su afinidad con los cultivos agrícolas propios del sector. Por consiguiente, esta investigación se planteó como objetivo principal determinar la diversidad de hongos formadores de micorrizas arbusculares presentes en la rizósfera del suelo de la GEUM y evaluar su efecto en el desarrollo de plantas de Ají.
MATERIALES Y MÉTODOS
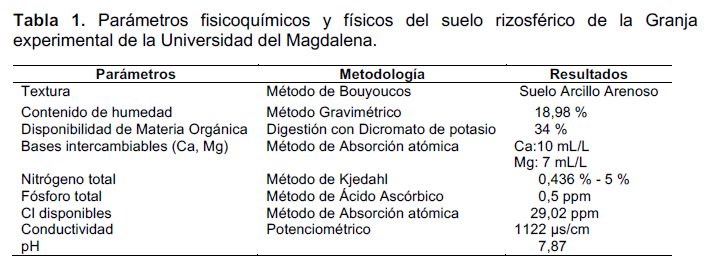
Obtención de muestras de suelo rizosférico. Las muestras fueron colectadas en la Granja Experimental de la Universidad del Magdalena (GEUM). Con ayuda de un barreno se extrajeron cinco muestras de suelo rizosférico a una Profundidad de 30 cm proveniente de los cultivos de yuca (Manihot esculenta Crantz) y maíz (Zea mays L.), de éstas se colectaron 500 g por muestra. Inmediatamente, fueron trasladadas al Laboratorio de Calidad de Agua de la Universidad del Magdalena para la realización de los análisis microbiológicos y fisicoquímicos.
Fase de Laboratorio. Previo a la realización de los análisis, todas las muestras fueron mezcladas homogéneamente con el fin de conformar una muestra compuesta, y a partir de ésta se realizaron los análisis correspondientes a la caracterización de los hongos micorrizógenos y análisis fisicoquímico.
Extracción y caracterización de hongos micorrizógenos arbusculares (HMA). La extracción y caracterización de los hongos micorrizógenos en las muestras de suelo rizosférico se realizó siguiendo el método recomendado por Sieverding (1983) y Brundrett (2008). Para tal fin, se tomaron cinco porciones de 100 g de suelo y se secaron en una estufa a 65 °C hasta registrar peso constante (peso seco). Posteriormente, el suelo se lavó repetidas veces con abundante agua agitándolo manualmente hasta observar poca turbidez y quedar libre de impurezas. Una vez decantado el centrifugado, se procedió a tamizarlo (tamices de 500, 90 y 63 µm de diámetro), seleccionando cuidadosamente las esporas de hongos, las cuales se colocaron por separado en tubos de ensayos con 5 mL de solución de sacarosa al 50% y se centrifugaron por dos minutos a 3500 rpm. Seguidamente, el sobrenadante que contenía las esporas se colocó en cajas de Petri, se determinaron tres morfotipos de hongos micorrizógenos, los cuales se identificaron con las claves taxonómicas según Bagyaraj y Stürmer (2012).
Masificación de los hongos micorrizógenos arbusculares. Previo a la masificación de los hongos, se procedió a seleccionar aquellos que presentaron mayor abundancia en las muestras analizadas (morfotipos hongo 1 y hongo 2). La masificación de los hongos micorrizógenos se realizó por el método de plantas trampas según Bagyaraj y Stürmer (2012). Para esto, se tomaron diez ejemplaras de plantas de maíz provenientes de los cultivos de la GEUM, cinco plantas se trasplantaron a maceteros con suelo estéril y 10 g de esporas del hongo 1 y las otras cinco se inocularon con 10 g de esporas del hongo 2. Se dejaron actuar por 60 días. Posteriormente, las plantas fueron extraídas y se les retiraron las raíces;; parte de éstas fueron tomadas (tres muestras de raíces inoculadas de cada hongo) para comprobar la colonización de los HMA. Para tal fin, las raíces seleccionadas se clarificaron con hidróxidos y ácidos (KOH 10 %, NH4OH 0,5 %, H2O2, HCl 5 %) e inmediatamente fueron teñidas con solución de azul de tripano al 0,05%, luego fueron observadas en el microscopio a 40 x detallando las hifas cenocíticas en el interior de las raíces. El resto de las raíces se limpiaron con agua y se cortaron en trozos de 10 mm y se mezclaron con el suelo donde fueron sembradas (suelo inoculado). Esta mezcla se mantuvo en stock para los ensayos de micorrización con plantas de ají.
Producción de plantas de ají en condiciones estériles. Se utilizaron 100 semillas de ají (Capsicum annuum L. “Chile Mulato”) para el cálculo del porcentaje de germinación. Para tal fin, las semillas se colocaron en una caja de Petri que contenía papel absorbente hidratado con agua destilada estéril. Posteriormente, fueron incubadas en un cuarto de cultivo del laboratorio de Biotecnología de la Universidad del Magdalena donde se les controló la humedad (80 %) y la iluminación (500 – 100 Lux). Las semillas seleccionadas para los ensayos presentaron un porcentaje de germinación del 97%.
Luego, se prepararon maceteros (2 x 2 x 7 cm) a los cuales se les adicionó 50 g de mezcla hidratada de suelo estéril y turba. Seguidamente, se sembraron cinco semillas de ají por cada macetero y se mantuvieron en las mismas condiciones antes señaladas durante 60 días. Las plantas de ají que presentaron al menos tres hojas primordiales y un sistema radicular estable fueron seleccionadas para los ensayos de inoculación con los hongos.
Análisis Fisicoquímico del suelo. La caracterización de los análisis fisicoquímicos en las muestras de suelo se realizó con el propósito de conocer las condiciones fisicoquímicas y físicas requeridas para el establecimiento de los cultivos. En la tabla 1, se describen cada uno de los parámetros evaluados con las técnicas analíticas establecidas por el IGAC (2006).
Establecimiento de las Micorrizas con plantas de ají. Los ensayos de micorrización se realizaron en el invernadero de la GEUM. Para esto, se tomaron las plantas de ají estériles y se trasplantaron a maceteros de 700 cm3 que contenían suelo y turba en varias proporciones como se indica en la tabla 2.
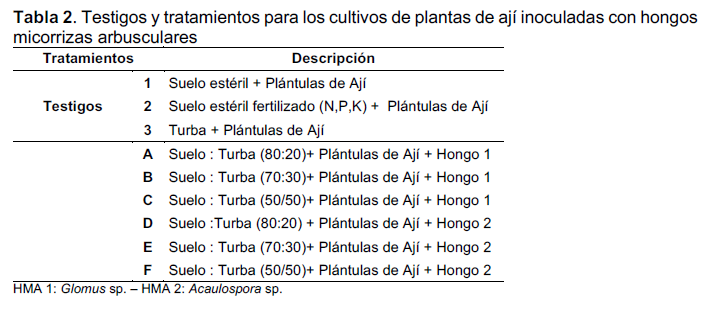
Previo a la siembra de las plantas de ají, las mezclas de suelo y turba fueron humedecidas, colocando en cada macetero 500 g de mezcla. Luego, se sembraron las plantas de ají adicionándole 10 g de suelo inoculado (± 300 esporas g-1 de suelo) distribuidos de forma homogénea cerca a la raíz, para asegurar una rápida inoculación y sobrevivencia del micelio. Estos cultivos fueron dejados en condiciones de invernadero por cuatro meses.
El diseño experimental que se desarrolló fue completamente aleatorio conformado por tres testigos y seis tratamientos, cada uno con diez plantas de ají, donde la variación de los tratamientos fue la combinación de las mezclas de suelo con turba y las dos cepas de hongos previamente seleccionados. Los ensayos se mantuvieron con riego tanto por cantidad como en periodicidad, para evitar problemas de exceso o falta de agua.
Evaluación de los ensayos de micorrización. Después de cuatro meses de siembra y luego de haber sido retiradas las plantas de ají de los maceteros, se procedió a medir la altura de las plantas, longitud radicular, peso seco de las plantas, recuento de esporas y porcentaje de colonización de los HMA en las raíces
Análisis estadístico. Para la evaluación de los parámetros morfológicos y biomasa de las plántulas, se realizó un Test de ANOVA con un nivel de confianza de 95% y posterior a esto la discriminación de los tratamientos se realizaron a través de un Test de Tukey, con un nivel de significancia de p<0,05. El porcentaje de colonización de los hongos en las raíces se les aplicó un análisis de varianza simple (ANOVA) y se compararon los resultados con la prueba de múltiples rangos de Duncan. Todos los análisis estadísticos se realizaron con el paquete estadístico IBM SPSS Statistics 21.0.0 v. 20.0 y Statgrapphiscs Plus v.5.1.
RESULTADOS Y DISCUSIÓN
Se identificaron tres géneros de hongos micorrizógenos del suelo rizosférico de la GEUM. El género Glomus fue el más frecuente encontrado en el suelo rizosférico del cultivo de yuca. No obstante, los géneros Acaulospora y Gigaspora fueron más predominantes en la rizósfera del cultivo de maíz (Tabla 3). El promedio del número total de esporas para los dos suelos rizosféricos muestreados fue de 230,5 esporas/100 g de suelo seco. Luego de los recuentos de esporas de los hongos, se seleccionaron de acuerdo a su abundancia dos de ellos para el establecimiento de las micorrizas con las plantas de ají. Los géneros Glomus (hongo 1) y Acaulospora (hongo 2).
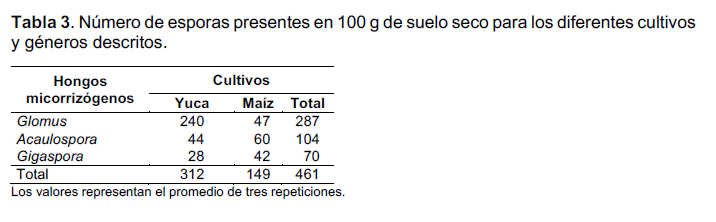
Los hongos micorrizógenos se encuentran ampliamente distribuidos en suelos de interés agrícola, hortícola y forestal. De hecho, se consideran microorganismos que contribuyen a la calidad y salud del suelo (Harrier y Watson 2003). La diversidad y abundancia de hongos formadores de micorrizas juegan un papel importante en la fertilización del suelo y su relación directa con las comunidades vegetales (Martínez y Pugnaire 2009). Por consiguiente, los géneros de hongos micorrizógenos encontrados en el suelo de la Granja Experimental de la Universidad del Magdalena (GEUM) corresponden naturalmente a un suelo influenciado por una amplia variedad de vegetación tanto de interés forestal como agrícola.
León-Velandia (2006) menciona que la riqueza de hongos micorrizas arbusculares determinados en suelos cultivados con yuca en dos regiones de la Amazonía colombiana son relativamente bajos, solo lograron identificar los géneros Glomus, Gigaspora y Acaulospora, siendo el género Glomus el más abundante. Por otro lado, Pérez-Luna et al. (2012) encontraron resultados similares en un estudio sobre micorrizas asociadas a cultivos de maíz en México. Los resultados de los autores mencionados anteriormente, coinciden de cierta forma con los hongos identificados y colectados en la rizósfera de los cultivos de yuca y maíz de la GEUM. Sin embargo, los resultados del conteo total de esporas de esta investigación están por debajo comparado con los resultados expuestos por los autores anteriores (superior a 400 esporas/ g de suelo).
Una razón explicativa a la incidencia de los géneros Glomus, Acaulospora y Gigaspora en la rizósfera de los cultivos de yuca y maíz podría atribuirse a las características fisicoquímicas y nutriciones del suelo de la GEUM y su competitividad con otras especies microbianas del suelo (Sharma et al. 2014). Adicionalmente, las raíces de las plantas de yuca y maíz suelen ser medios de albergues (plantas trampas) y formar fácilmente la relación simbiótica (Baum et al. 2015). En la tabla 4, se presentan los parámetros de desarrollo evaluados en cada uno de los ensayos con las plantas de ají, cada uno de los valores representa el promedio de los parámetros evaluados. Estadísticamente, fueron escogidos seis grupos (a, b, c, d, ab, bc) que representan la diferencia promedio en cada uno de los parámetros y en cada uno de los tratamientos con el mismo grupo. Promedios con la misma letra no son significativamente diferentes a (P<0,05).
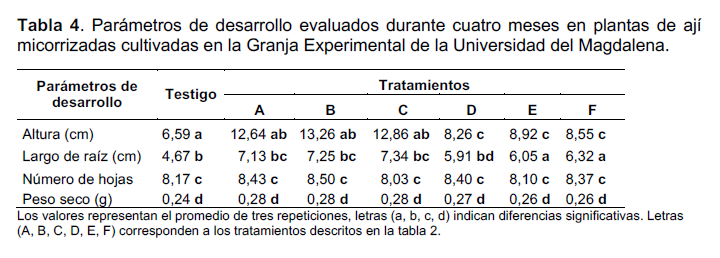
Entre los tratamientos los mayores registros en el número de hojas y altura de las plantas se obtuvieron en el tratamiento B. En ese mismo orden de parámetros, los tratamientos E y F correspondieron a los valores más bajos para las plantas de ají cultivadas en estos tratamientos. En lo que respecta al largo radicular y peso seco de las plantas de ají, los mayores valores de estos parámetros se determinaron en el tratamiento C, mientras que en el tratamiento D se registró el menor largo radicular. Los tratamientos E y F fueron los tratamientos con el menor peso seco de las plantas evaluadas. Los parámetros de desarrollo evaluados en las plantas de ají inoculadas con Glomus y Acaulospora mostraron un efecto positivo comparado con el control (turba), puesto que se observó un mayor número de hojas (8,3 - 8,5 hojas), incremento en el tamaño de las plantas (8,5 – 13,2 cm), largo radicular (6,0 – 7,2 cm) y peso seco (0,26 – 0,28 g) durante los cuatro meses que tardaron los ensayos. Sin embargo, entre los tratamientos las plantas tratadas con Glomus respondieron mejor (diferencias significativas) que las inoculadas con Acaulospora efecto que se puede atribuir a la efectividad del hongo. Estudios realizados por Sharif y Claassen (2011) demuestran que las micorrizas arbusculares aumentan la absorción de fosforo de Capsicum annuum en suelos con bajas concentraciones de oxisoles, afirmando que la cantidad de captación de fosforo está determinada por la superficie externa de las hifas y no por las raíces de la plantas. Así mismo, Sensoy et al. (2007) mencionan que la interacción entre Capsicum annuum con los hongos micorrizógenos Glomus intraradices y Gigaspora margarita contribuyen al desarrollo de las plántulas de ajíes, incrementando la altura, largo radicular y peso seco de las plantas. Por otro lado, Boonlue et al. (2012);; concluyeron que el hongo Acaulospora, no solo aumenta el crecimiento de la planta de chile (Capsicum frutescens) sino que también mejora la floración y la fructificación de la planta mediante la captación de fosforo a través de la inoculación con el hongo.
En otro estudio, Castillo et al. (2009) reportaron un efecto similar en un estudio realizado con plantas de ají variedad cacho de cabra inoculadas con hongos micorrizógenos nativos y Glomus claroideum cultivadas en condiciones de invernadero durante 90, 170 y 205 días. Estos autores reportaron alturas desde 45 hasta 70 cm. A pesar, de que en el presente estudio, los resultados difieren notoriamente del antes mencionado, quizás una posible razón se debe a la no prolongación del tiempo de los cultivos.
En la tabla 5 se presentan los valores del número de esporas por gramo de suelo seco y los porcentajes de inoculación micorrízica calculados en las plantas de ají durante cuatro meses. Los mayores valores en el número de esporas y porcentaje de inoculación se presentaron en los tratamientos A y F respectivamente. En ese mismo orden, los tratamientos F y D registraron los valores más bajos.
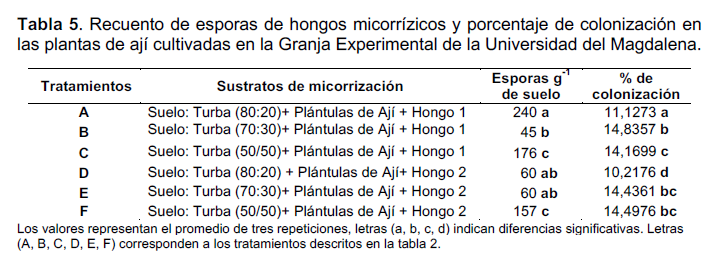
La mezcla de suelo con fertilizantes orgánicos como gallinaza, estiércol y abonos verdes contribuyen a una mejor estabilidad en el desarrollo de los hongos formadores de micorrizas, lo cual se ve reflejado en una alta diversidad y número de esporas libres en el suelo (Serralde y Ramírez 2004). En contraposición, el número de esporas estimadas en las muestras de suelo de esta investigación procedían de suelos no fertilizados incidiendo de manera directa en el bajo número de esporas. Los valores más altos en el recuento de esporas lo presentaron los tratamientos que incluyeron la mezcla de suelo y turba en proporción de 80:20 respectivamente tanto para Glomus como para Acaulospora;; mientras que los valores más bajos se registraron para los tratamientos que incluyeron la mezcla de suelo y turba en proporción 50:50 para ambos hongos. Esta variación puede atribuirse al efecto de la turba en la viabilidad de los hongos. Por lo general, en los ensayos de inoculación de plantas con micorrizas, se emplean para la multiplicación de los hongos sustratos que permitan la aireación, baja proporción de nutrientes disponibles que no inhiban el establecimiento de la asociación y que esté libre de patógenos (Usuga et al. 2008). En estudios realizados por Jaizme y Rodríguez (2004) sobre el uso de las micorrizas en bananos, reportaron algunas turbas y sustratos orgánicos como causantes de efectos negativos en el número de esporas de
Glomus;; lo cual coinciden con los resultados obtenidos en esta investigación.
El recuento de esporas y el porcentaje de inoculación no siempre están relacionados, ya que la producción de estructuras vegetativas de los hongos como propágulos en términos ecológicos puede estar limitada, dependiendo en parte de los parámetros fisiológicos del hospedador y por ende, no estaría colonizada la raíz (Merryweather y Fitter 1998). En ese sentido, no necesariamente tiene que existir una relación directamente proporcional entre el porcentaje de colonización y el número de esporas viables. No obstante, la falta de esporulación no significa ausencia de las micorrizas en el suelo estudiado. Los porcentajes de colonización registrados en este estudio fueron muy cercanos entre los tratamientos, confirmando efectivamente que los valores bajos en el número de esporas no influyeron en el porcentaje de colonización de las plantas de ají.
CONCLUSIÓN
El establecimiento de la asociación de las micorrizas (Glomus y Acaulospora) con las plantas de ají respondieron de manera satisfactoria, lográndose un aumento en los parámetros de desarrollo (número de hojas, altura, largo radicular y peso seco). Sin embargo, las plantas de ají cultivadas en la mezcla de suelo y tuba en proporción 70:30 adicionado de Glomus fueron las más desarrolladas. El número de esporas tanto de Glomus como de Acaulospora en los distintos tratamientos fue heterogéneo, efecto atribuido a las proporciones entre el suelo y la turba. En cuanto al porcentaje de colonización determinados en las raíces de las plantas de ají fueron cercanos para todos los tratamientos.
REFERENCIAS
Aguilera, L., Olalde, V., Arriaga, M. y Contreras, R. 2007. Micorrizas arbusculares. Ciencia Ergo Sum 14 (3): 300-306.
Azcón-Aguilar, C., Palenzuela, J., Roldán, A., Bautista, S., Vallejo, R. and Barea, J. 2003. Analysis of the mycorrhizal potential in the rhizosphere of representative plant species from desertification-threatened Mediterranean shrublands. Applied Soil Ecology. 22: 29-37. Doi: http://dx.doi.org/10.1016/S0929-1393(02)00107-5
Bagyaraj, J. y Stürmer, S. 2012. Hongos Micorrizógenos Arbusculares (HMA). En: Moreira, F, Huising, E, Bignell, D. (Eds). Manual de Biología de Suelos Tropicales.
Instituto Nacional de Ecología. México D.F. México. 217 – 241.
Baum, C., El-Tohamy, W. and Gruda, N. 2015. Increasing the productivity and product quality of vegetable crops using arbuscular mycorrhizal fungi: A review. Scientia
Horticulturae 187: 131-141. Doi: http://dx.doi.org/10.1016/j.scienta.2015.03.002
Błaszkowski, J., Chwat, G., Goralska, A. and Bobrowska-Chwat, A. 2015. Glomus tetrastratosum, a new species of arbuscular mycorrhizal fungi (Glomeromycota). Mycoscience 56: 280-286. Doi: http://dx.doi.org/10.1016/j.myc.2014.08.003
Boonlue, S., Surapat, W., Pukahuta, C., Suwanarit, P., Suwanarit, A. and Morinaga, T. 2012. Diversity and efficiency of arbuscular mycorrhizal fungi in soils from organic chili (Capsicum frutescens) farms. Mycoscience 53:10–16. Doi: 10.1007/s10267-011-0131-6
Brundrett, M. 2008. Mycorrhizal Associations: The web resource. Autralian Center for International Agricultural Research. The University of Western Australina, School of Plant Biology Lotterywest. Disponible en: http://mycorrhizas.info/method.html (marzo 18 de 2015).
Castillo, C., Ortiz, C., Borie, F. y Rubio, R. 2009. Respuesta de ají (Capsicum annuum L) CV “cacho de cabra” a la inoculación de hongos micorrízicos arbusculares.
Información Tecnológica 20(4):3-14. Doi: http://dx.doi.org/10.4067/S0718-07642009000400002
Harrier, L. and Watson, C. 2003. The role of fungi in sustainable cropping systems. Advance in Agronomy 79: 186-225. Doi: http://dx.doi.org/10.1016/S0065-2113(02)79004-4
Instituto Geográfico Agustín Codazzi-IGAC. 2006. Métodos de Análisis del Laboratorio de Suelos. Sexta edición. Bogotá. 648 p.
Jaizme, M. y Rodríguez, A. 2004. Uso de las micorrizas en banano: logros y perspectivas. Memorias XVI Reunión Internacional ACORBAT. Oxaca, México. 143-160. Jeffries, P., Gianinazzi, S., Perotto, S., Turnau, K. and Barea, J. 2003. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility. Biology and Fertility of Soils 37: 1-16. Doi:10.1007/s00374-002-0546-5
León-Valencia, D. 2006. Evaluación y caracterización de micorrizas arbusculares asociadas a yuca (Manihot esculenta sp.) en dos regiones de la Amazonía colombiana. Tesis Microbiólogo, Pontificia Universidad Javeriana, Cundinamarca, Bogotá. 125p.
Martínez, L. y Pugnaire, F. 2009. Interacciones entre las comunidades de hongos formadores de micorrizas arbusculares y de plantas. Algunos ejemplos en los ecosistemas semiáridos. Ecosistemas18 (2): 44-54.
Merryweather, J. and Fitter, A. 1998. The arbuscular mycorrhizal fungi of hyacinthoides non-scripta II. Seasonal and spatial patterns of fungal population. The New Phytologist 138: 131-142.
Munkvold, L., Kjoller, R., Vestberg, M., Resendahl., M. and Jakobsen, I. 2004. High functional diversity within species of arbuscular mycorrhizal fungi. The New Phytologist 164:357-364. Doi:10.1111/j.1496-8137.2004.01169.x
Pérez, C. y Peroza, V. 2013. Micorrizas arbusculares asociadas al pasto angleton
(Dichathium aristatum Benth) en fincas ganaderas del municipio de Tolú, Sucre-Colombia. Revista MVZ Córdoba 18 (1):3362-3369.
Pérez-Luna, Y., Álvarez, J., Mendoza, J., Pat, J., Gómez., R. y Cuevas, L. 2012. Diversidad de hongos micorrícicos arbusculares en maíz con cultivo de cobertura y biofertilizantes en Chiapas, México. Gayana Botánica 69(1): 46-56. Doi:http://dx.doi.org/10.4067/S0717-66432012000100006
Rivera, R., Fernández, F., Hernández, A., Triana, J. y Fernández, K. 2003. El manejo efectivo de la simbiosis micorrízica, una vía hacia la agricultura sostenible. Estudio de caso: El Caribe. INCA Ediciones. La Habana, Cuba.166p.
Sensoy, S., Demir, S., Turkmen, O., Erdinc, C. and Burak, S. 2007. Responses of some different pepper (Capsicum annuum L.) genotypes to inoculation with two different arbuscular mycorrhizal fungi. Scientia Horticulturae 113:92-95. Doi: http://dx.doi.org/10.1016/j.scienta.2007.01.023
Serralde, A. y Ramírez, G. 2004. Análisis de poblaciones de micorrizas en maíz (Zea mays) cultivado en suelos ácidos bajo diferentes tratamientos agronómicos. Revista Corpoica 5(1): 31-40.
Sharma, S., Kumar, D. and Kumar-Yadav, S. 2014. Glomus–Azotobacter association affects phenology of mango seedlingsunder reduced soil nutrient supply. Scientia Horticulturae 173: 86–91. Doi:http://dx.doi.org/10.1016/j.scienta.2014.04.039
Sharif, M. and Claassen, N. 2011. Action mechanisms of arbuscular mycorrhizal fungi in phosphorus uptake by Capsicum annuum L. Pedosphere 21(4):502-511. Page.
510. Doi: http://dx.doi.org/10.1016/S1002-0160(11)60152-5 Sieverding, E. 1983. Manual de métodos para la investigación de la micorriza vesícula-arbuscular en el laboratorio. Centro Internacional de Agricultura Tropical. Proyecto micorriza. Cali, Colombia. 116 p.
Usuga, C., Castañeda, D. y Franco, A. 2008. Multiplicación de hongos micorriza arbuscular (H.M.A) y efecto de la micorrización en plantas micropropagadas de banano (Musa AAA cv. Gran Enano) (Musaceae). Revista Facultad Nacional de Agronomía Medellín 61(1): 4279-4290.